Соли
Содержание:
- Способы лечения болезней солью
- Как снизить выделение соли с мочой при помощи диеты
- Влияние на организм человека
- Классификация
- Особенности кристаллогидратов
- Способы получения солей
- Типы солей
- Применение
- Значение соли для человеческого организма
- Оксалаты – соли щавелевой кислоты
- История
- Полезные свойства
- Распространение солей
- обучение
- Химические свойства комплексных солей (на примере соединений алюминия и цинка)
- Огурцы с лимонной кислотой и болгарским перцем
- Соли мочевой кислоты – ураты
- Методы получения[править | править код]
- Значение морской соли для организма
- Ароматные хрустящие консервированные огурцы с лимонной кислотой
Способы лечения болезней солью
При появлении первых симптомов недомоганий не спешите отправляться в аптеку, улучшить состояние можно народными методами, без использования синтетических средств.
Морская соль оказывает антибактериальное, антисептическое, ранозаживляющее действия. Ее используют для приготовления растворов для промывания носовых проходов, полоскания горла, ванн, проведения ингаляций. Это природный обеззараживающий, противовоспалительный агент, который борется с ОРВИ заболеваниями, простудой, ревматизмом, артрозом, нейтрализует радиационное излучение .
Способы лечения солью:
- Ингаляции. Назначаются для профилактики и лечения заболеваний дыхательных путей, имеют общеукрепляющее значение. Принцип действия процедуры основывается на том, что с вдохом лечебного пара в легкие попадают полезные вещества, которые убивают болезненные микроорганизмы, обеззараживают слизистые оболочки гортани и носоглотки, снимают отечность, разжижают мокроту, насыщают ткани биологически активными соединениями. В результате самочувствие больного улучшается, болезнь быстрее отступает .
Для усиления эффекта положите в чайник хвойный экстракт, крапиву, эвкалипт, шалфей или липовый цвет. Такие ингаляции проводят 2 раза в сутки.
Для приготовления лечебного пара растворите 30 грамм морской соли в литре воды. Полученную смесь доведите до кипения, варите 5 минут. Дышите данным раствором 10 минут. Для устранения проблем с верхними дыхательными путями вдыхайте через рот, выдыхайте через нос, для лечения заболеваний носоглотки процедуру проводите наоборот.
Ингаляции противопоказаны гипертоникам, людям с сердечной и легочной недостаточностью, при носовом кровотечении, повышенной температуре тела, детям до 2-х лет.
- Промывания носовой полости, полоскание горла. Симптомы простуды, гайморит, тонзиллит, ангина, синусит, ринит отступают, если обеззараживать слизистые оболочки солевым раствором. Это самый безопасный и эффективный способ очищения носовых ходов от патогенной слизи. Солевое промывание повышает местный иммунитет, удаляет микрочастицы раздражителей (бактерии, пыльцу, пыль), укрепляет капилляры, уменьшает отек слизистой оболочки, ускоряет выздоровление. Раствор с хлористым натрием уменьшает воспалительные реакции, снижает вероятность инфицирования организма .
Способ приготовления обеззараживающего средства для промывания носовых ходов и полоскания горла: растворите 7 – 10 грамм морской соли без добавок в 500 миллилитрах горячей воды. Раствор остудите до приемлемой температуры (он должен быть теплым). Процедуру выполнять 3 – 5 раз в день.
- Морская ванна. Лечебные свойства: облегчает ревматоидные спазмы, восстанавливает подвижность и гибкость суставов, избавляет от остеохондроза, кожных заболеваний (псориаза, нейродермитов, витилиго, экземы). Горячие ванны с температурой воды до 42 градусов эффективны при артритах, нервно-психических расстройствах, патологиях печени, почек. Курс лечения – 10 – 15 процедур, длительностью по 15 минут, ежедневно или через день. Противопоказания: болезни сердечно-сосудистой системы .
Приготовление ванны: наберите воду до 35 градусов, растворите 1,5 килограмма морской соли. Лягте, чтобы ноги находились немного выше головы (это облегчит работу сердца). Процедуры проводить в вечернее время не позднее, чем за 1 час до сна.
Почему соль называют «белой смертью»?
Данный термин относится к обычной столовой соли. Такой продукт полностью рафинирован и лишен полезных свойств. Поэтому для употребления внутрь и наружного применения рекомендуется использовать исключительно морскую соль, обогащенную микроэлементами. В процессе производства ее не подвергают термической обработке, поэтому продукт сохраняет максимум питательных веществ в составе .
Как снизить выделение соли с мочой при помощи диеты
Чтобы ослабить кристаллурию, нужно откорректировать питание. Для этого из рациона исключаются продукты, содержащие вещества, вызывающие образование солей. Не рекомендуется есть соленую, копченую, маринованную пищу. Ограничивается употребление жирных и жареных блюд.
| Вид солей | Продукты, от которых лучше отказаться | Ограничение продуктов |
| Ураты | Наваристые бульоны, острые блюда, животный жир, майонез, маргарин, кетчуп, бобовые, кислые фрукты и овощи, грибы, орехи, семечки подсолнуха. Напитки – морсы, отвар шиповника, квас, кофе, шоколад, алкогольные напитки, особенно пиво |
Мясо и птица. Разрешается малое количество нежирных сортов в отварном виде или на пару.
Ограничивается употребление жирной рыбы, морепродуктов, топленого сливочного масла, некислых соков |
| Оксалаты | Наваристые бульоны, грибы, жирное мясо, острые блюда, колбасы, копчености, соус, кетчуп, животный жир, кислые фрукты и овощи, шоколад, газировка, ягодные и фруктовые морсы, кофе, какао, квас. Запрещаются овощи – редька, свекла, щавель, листовой салат | Кондитерские изделия, нежирный творог, мороженое, огурцы, томаты, патиссоны, лук, смородина, ежевика, клубника, грибы, семечки, орехи, капуста, черемша, сельдерей, укроп, петрушка |
| Фосфаты | Сдобная выпечка, свежий хлеб, жирный творог, сыр, сметана, молоко, наваристые бульоны, икра, рыба, морепродукты, маринады, копчености, животные жиры, листовой салат, капуста, сладкие яблоки и груши, черника, малина, черешня, хурма, виноград, мёд, зефир, мармелад. Нельзя употреблять газированные напитки, какао, кофе, шоколад | Постное мясо, куры, индейка, варёные яйца, огурцы, зеленый лук, клубника, смородина, ежевика, грибы, семечки, орехи |
Сочетание диеты и медикаментозной коррекции выявленных нарушений позволяет избавиться от солей в моче, развития мочекаменной болезни и подагры.
Влияние на организм человека
Контакт с соляной кислотой может привести к негативным последствиям. Из-за того, что это едкое вещество, следует избегать попаданий Е507 на открытые участки кожи и слизистые оболочки, в противном случае может образоваться сильный ожог. Наибольшую опасность кислота представляет для глаз. В момент раскупоривания сосуда с соляной кислотой, мгновенно выделяются пары хлороводорода и образуется туман, вдыхание которых ведёт к сильному раздражению дыхательных путей и слизистых оболочек, удушью. Вступая в реакцию с хлорной известью, перманганатом калия или диоксидом марганцы, Е507 образует очень токсичный и опасный газообразный хлор. Тем не менее, слабые растворы Е507, используемые в пищевой промышленности, человеческому здоровью ничем не грозят.
Соляная кислота — входит в состав желудочного сока, поэтому иногда её слабоконцентрированный раствор назначают при недостаточной кислотности желудочного сока.
Классификация
Сегодня существует множество разновидностей соли, которая отличается по цвету, вкусу, химическому составу, а также степени помола и очистки. Среди широкого ассортимента несложно растеряться. Какой же из них отдать предпочтение?
Виды соли:
- Йодированная. Полезна людям, проживающим в экологически неблагоприятных районах. Противопоказана при гиперактивности щитовидной железы.
- Экстра. Представляет собой «агрессивный» вид соли, поскольку в его состав входит исключительно чистый хлорид натрия. В процессе производства продукта (выпаривания воды, очистки содой) уничтожаются все полезные микроэлементы, поэтому она практически не представляет ценности для организма человека.
- Каменная. Это натуральная соль сероватого цвета, добываемая из шахт.
- Черная. Представляет собой природный неочищенный продукт. Улучшает пищеварение, оказывает слабительный эффект. Черная соль содержит калий, йод, серу, железо.
- Поваренная. По сути, это отбеленная каменная соль, в гранулах.
- Морская. Самый полезный продукт, природный источник микроэлементов. В ее состав входят: натрий, хлор, кальций, калий, фосфор, магний, марганец, цинк, железо, селен, медь, кремний, йод .
Морскую соль извлекают из водных просторов планеты. Она гораздо полезнее, чем каменная или поваренная. Ее цвет (серый, розовый, черный, красный) и вкус (насыщенный, нежный или острый) определяются местными видами водорослей и глины, сосредоточенными в испарительных прудах. Используется для лечения гайморита, пневмонии, пародонтоза, гипертонии, ревматизма, при отравлениях.
По месту добычи различают следующие подвиды морской соли: «Малдонская» (Англия), «Terre de Sel» и «Sel gris» (Франция), «Rose» (Боливия), «Гималайская» (Пакистан), «Гавайская красная» или «Гавайская черная», «Кala namak» (Индия), «Персидская синяя» (Иран).
- Диетическая. Отличительная особенность данного вида – пониженное содержание натрия. В состав диетической соли входят калий и магний, поддерживающие работу сердца и сосудов.
Соль классифицируют по способу помола (крупная, средняя, мелкая), чистоте (высший, первый, второй сорт).
Продукт активно используют в пищевой промышленности, медицине, косметологии.
В кулинарии крупную соль используют исключительно для консервирования овощей, засолки рыбы, приготовления супов, круп. Средний помол применяется для улучшения вкуса маринада, сухого посола мяса, запекания рыбы. Мелкую соль добавляют в готовые блюда (закуски, салаты), подают к столу. Она быстро растворяется, не скрипит на зубах.
Рассмотрим в чем уникальность такого дарования природы.
Особенности кристаллогидратов
Все существующие MnAcm отличаются своей классификацией. Швейцарский учёный А. Вернер и российский химик В. Освальд внесли огромный вклад в изучение комплексных солей (КС). В результате проведённых лабораторных исследований удалось определить, что КС состоит из различных частиц. Имеющийся центральный элемент называется комплексообразователем, а все связанные с ним элементы — лигандами. Их итоговое количество рассматривается исключительно как координационное число химического соединения. К лигандам могут относиться не только нейтральные молекулы, но и различные ионы, катионы водорода.
На уроках химии в 8 классе можно узнать, что комплексные MnAcm принято делить на три группы: анионные, нейтральные, а также катионные. Все эти типы химических веществ образуются благодаря разным лигандам:
- Если с комплексообразователем связаны молекулы аммиака, тогда речь касается аммиакатов.
- Сформированные лигандами Н2О аквакомплексы.
- Наличие кислотных остатков свойственно для ацидокомплекса.
Кристаллогидратами принято называются те кристаллы, которые образуются в водном растворе после выпадения солей в осадок. На основании этой реакции базируются многие школьные эксперименты, которые проводятся на уроках химии. Если всё сделано правильно, то между молекулами Н2О и солевыми растворами будут сформированы прочные связи. В итоге образуется кристаллическая решётка. Средние MnAcm можно получить только тогда, когда в кислоте все атомы водорода замещены металлом.
Все химические реакции кристаллогидратов должны быть записаны только в виде количественного соотношения MnAcm и Н2О, разделённых точкой. Например, Na2SO4 ⋅ 10H2O. Если речь касается номенклатуры, тогда для корректного обозначения Н2О должны быть задействованы греческие числа, с которых начинается название. В противном случае будет допущена ошибка. Число должно выступать в роли приставки к слову «гидро», а уже после этого указывается название соли. Например: правильно записать дигидрат сульфат кальция можно только так — CaSO4 ⋅ 2H2O.
Способы получения солей
Способы получения и химические свойства солей. Соли могут быть получены из неорганических соединений практически любого класса. Наряду с этими способами соли бескислородных кислот могут быть получены при непосредственном взаимодействии металла и неметалла (Cl, S ит. д.).
Многие соли устойчивы при нагревании. Однако соли аммония, а также некоторые соли малоактивных металлов, слабых кислот и кислот, в которых элементы проявляют высшие или низшие степени окисления, при нагревании разлагаются.
СаСO3 = СаО + СO2
2Ag2CO3 = 4Ag + 2СO2 + O2
NH4Cl = NH3 + НСl
2KNO3 = 2KNO2 + O2
2FeSO4 = Fe2O3 + SO2 + SO3
4FeSO4 = 2Fe2O3 + 4SO2 + O2
2Cu(NO3)2 = 2CuO + 4NO2 + O2
2AgNO3 = 2Ag + 2NO2 + O2
NH4NO3 = N2O + 2H2O
(NH4)2Cr2O7 = Cr2O3 + N2 + 4H2O
2КСlO3 =MnO2= 2KCl + 3O2
4KClO3 = 3КСlO4 + KCl
Получение солей
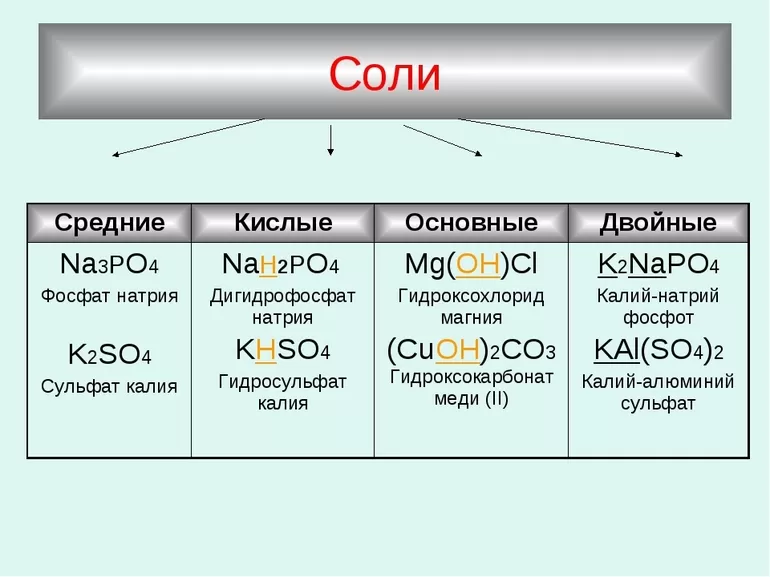
Типы солей
А теперь давайте более подробно рассмотрим классификацию солей.
Классификация:
• К кислым солям относятся такие, в которых атомы водорода в кислоте частично заменены атомами металла. Их можно получить с помощью нейтрализации основания избытком кислоты.
• К средним солям или как их еще нормальным, относятся такие соли, у которых в молекулах кислоты все атомы водорода замещены на атомы металла, например, таких, как Na2CO3, KNO3 и т.д.
• К основным солям относятся те, где у которых происходить неполное или частичное замещение гидроксильных групп оснований кислотными остатками, такими, как: Аl(OH)SO4 , Zn(OH)Cl и т.д.
• В составе двойных солей находится два различных катиона, которые получаются с помощью кристаллизации из смешанного раствора солей с разными катионами, но одинаковыми анионами.
• Но, а к смешанным солям относятся такие, в составе которых находятся два различных аниона.
• Также существуют комплексные соли, в состав которых входит комплексный катион или комплексный анион.
Применение
В Российской Федерации пищевая добавка Е386 разрешена в качестве антиокислителя при производстве маргарина и соусов в количестве до 100 мг/кг. При производстве растительных консервов (из овощей и грибов) и консервов из морепродуктов (ракообразных и моллюсков) в количестве до 75 мг/кг. Из-за своей способности образовывать прочные хелатные соединения с металлами этилендиаминтетраацетат динатрия используют в качестве стабилизатора окраски и вкуса продукта. Пищевую добавку применяют при производстве майонеза (до 75 мг/кг), растительных и рыбных консервов из светлоокрашенных продуктов (цветной капусты, лука, грибов, картофеля, яблок) в количестве до 100 мг/кг. Используют её также при производстве фруктовых соков (до 50 мг/л) и ароматических масел и экстрактов (до 300 мг/л). Пищевая добавка Е386 оказывает также консервирующее действие, вследствие взаимодействия с кальцием из бактериальных мембран. При обработке пива трилоном Б увеличивается его срок хранения на два месяца.
Другие сферы применения динатриевой соли этилендиаминтетрауксусной кислоты
Основная функция динатриевой соли этилендиаминтетрауксусной кислоты: делает нерастворимые соли металлов растворимыми. Трилон Б является торговым названием динатриевой соли этилендиаминтетрауксусной кислоты и представляет собой кристаллический порошок белого цвета. Данное название введено фирмой BASF и использовалась как торговая марка для данного вещества, но очень быстро вошло в обиход и используется другими фирмами для обозначения продукта.
Используются также тринатриевая и тетранатриевая соль этилендиаминтерауксусной кислоты, но для связывания одного и того же количества ионов их надо брать в большем количестве. Трилон Б это ионкоагулянт. Схема действия его основана на извлечении ионов металла из нерастворимых солей металлов и замещения их на ионы натрия, почти все соли которого растворимы в воде причём независимо от валентности металла 1 молекула трилона реагирует с 1 молекулой металла. Это ценное свойство нашло огромное применение в аналитике. Поэтому Трилон Б широко применяется: — в аналитической химии для определения многих катионов и анионов, напр.: Ca, Mg, Cu, Со, Ni, Zn, Fe, Mo, Al (для качественного и количественного определения солей металлов, благодаря возможности вещества образовывать с ионами металлов комплексоны, окрашенные в различный цвет. Причём цвет раствора будет зависеть от иона металла, с которым образован комплекс) редкоземельных элементов, Tc, U, SO42−, PO43−, CN− и др., при потенциометрических, полярографических и амперометрических определениях, для маскировки, — в производстве медицинских препаратов и при отравлениях тяжёлыми металлами, — в производстве бытовой химии и синтетических моющих средств, — при консервировании и др
— в реставрации для удаления следов коррозии с изделий из бронзы и других цветных металлов, особо хорошо себя проявляет в очистке изделий из серебра (осторожно препарат может безнадёжно испортить изделие, нарушив патину). — в промышленности для промывки теплоэнергетического оборудования, труб, котлов; водоподготовки в котельных и теплосетях; для очистки автомобильных систем охлаждения, защиты стиральных машин как отдельный препарат или в комплексе со стиральным порошком; в виде стабилизатора в процессах полимеризации; в целлюлозно-бумажной промышленности; при производстве каучука; в аналитической химии и в многих других областях
Значение соли для человеческого организма
В обществе давно идут дискуссии о вреде и пользе соли, которую она оказывает на организм человека. Но какой бы точки зрения не придерживались оппоненты, следует знать, что поваренная соль это минеральное природное вещество, которое жизненно необходимо для нашего организма.
Также следует знать, что при хронической нехватке в организме хлорида натрия, можно получить летальный исход. Ведь, если вспомнить уроки биологии, то нам известно, что тело человека на семьдесят процентов состоит из воды. А благодаря соли происходят процессы регулирования и поддержки водного баланса в нашем организме. Поэтому исключать употребление соли ни в коем случае нельзя. Конечно же, безмерное употребление соли так же ни к чему хорошему не приведет. И тут напрашивается вывод, что все должно быть в меру, так как ее недостаток, также как и избыток могут привести к нарушению баланса в нашем рационе.
Оксалаты – соли щавелевой кислоты
Эти вещества образуются при реакции щавелевой кислоты с аммиаком, кальцием, калием или натрием. Выделение оксалатов с мочой называется оксалатурией.
Наличие оксалатов в моче часто вызвано вымыванием кальция из костей, что может приводить к патологическим переломам, возникающим при минимальной нагрузке на кости.
Причины оксалатурии:
- Несоответствие уровня гормонов щитовидной и паращитовидных желез, регулирующих содержание кальция в костях. При гормональном дисбалансе костный кальций начинает вымываться, обнаруживаясь в виде солей в моче.
- Кишечные патологии – болезнь Крона, воспаления (колиты). В этом случае нарушается поступление веществ, участвующих в кальциевом обмене, что приводит к солеобразованию.
- Передозировка витаминов – пиридоксина (В6) и витамина C (аскорбиновой кислоты), – которая возникает при приеме витаминных препаратов без врачебных рекомендаций.
- Излишнее поступление оксалатов с пищей.
Оксалаты могут откладываться в почках, вызывая образование оксалатных камней, имеющих неровную поверхность и царапающих почечную слизистую. При их отложении у пациентов обнаруживается кровь в моче – гематурия – и может развиться почечная колика.
В урине при бактериальном поражении почек иногда обнаруживаются солевые соединения струвиты – кристаллы, состоящие из фосфата магния-аммония и карбоната кальция. Они вызваны выделением болезнетворными микроорганизмами особых ферментов, защелачивающих мочу и вступающих с ней в реакцию.
История
Вещества этой группы по существу представляют собой первое поколение пестицидов. Еще до начала второй мировой войны одновременно в США и Германии была открыта сначала росторегулирующая, а потом и гербицидная активность 2,4-дихлорфеноксиуксусной кислоты. В 1945-1946 годах в США уже было начато производство 2,4-Д. Благодаря высокой активности по отношению к двудольным сорнякам в посевах риса, зерновых колосовых и кукурузы, гербициды этой группы получили всеобщее признание в мировом земледелии.
Эра гербицидов в России связана с интенсивным изучением данной группы препаратов в 1943 г. в Московской сельскохозяйственной академии им. К.А.Тимирязева, а затем во Всесоюзном научно-исследовательском институте защиты растений и во Всесоюзном научно-исследовательском институте агрохимии и агропочвоведения им. Д.Н.Прянишникова.
Полезные свойства
Соль не вырабатывается организмом самостоятельно, но имеет очень важное значение в обменных процессах. Хлор нужен для синтеза соляной кислоты в желудке, а также других веществ, которые отвечают за расщепление жира
А натрий обеспечивает корректную работу мышц и нервной системы, он влияет на состояние костей и усвоение питательных веществ толстым кишечником.
Соль участвует в обменных процессах на уровне клеток, благодаря ей ткани получают необходимое количество элементов. Натриево-калиевое соединение отвечает за проникновение аминокислот и глюкозы через клеточную мембрану.
Кроме того, пищевая соль обладает отличными антибактериальными свойствами. Она является эффективным защитником от вредоносных бактерий.
Еще одно полезное свойство хлорида натрия состоит в том, что он усиливает вкус продуктов, способствуя увеличению удовольствия от их потребления и аппетиту.
Распространение солей
Что такое соль? Этот элемент является одним из самых распространенных химических соединений. Всем известны поваренная соль, мел (карбонат кальция) и прочее. Среди солей карбонатной кислоты самым распространенным является карбонат кальция. Он является составной частью мрамора, известняка, доломита. А еще карбонат кальция — основа для формирования жемчуга и кораллов. Это химическое соединение является неотъемлемой составляющей для формирования твердых покровов у насекомых и скелетов у хордовых животных.
Поваренная соль известна нам с детства. Врачи предостерегают от ее чрезмерного употребления, но в умеренных количествах она крайне необходима для осуществления жизненных процессов в организме. А нужна она для поддержания правильного состава крови и вырабатывания желудочного сока. Физрастворы, неотъемлемая часть инъекций и капельниц, есть не что иное, как раствор поваренной соли.
обучение
Как образуются кислые соли? Они являются продуктом нейтрализации, то есть реакции кислоты с основанием. Поскольку эти соли имеют кислые протоны, нейтрализация может быть не полной, а частичной; в противном случае получается нейтральная соль, как видно из химических уравнений:
H2A + 2NaOH => Na2A + 2H2O (Завершено)
H2A + NaOH => NaHA + H2O (Частичное)
Кроме того, только полипротонные кислоты могут иметь частичную нейтрализацию, так как кислоты HNO3, HF, HCl и т. Д. Имеют только один протон. Здесь кислой солью является NaHA (что является вымышленным).
Если вместо нейтрализации дипротоновой кислоты H2А (точнее, гидразид), с Са (ОН)2, тогда кальциевая соль Ca (HA) была бы сгенерирована2 соответственно. Если Mg (OH) был использован2, вы получите Mg (HA)2; если LiOH, LiHA были использованы; CsOH, CsHA и т. Д..
Исходя из этого, делается вывод о том, что соль образована анионом А, который образуется из кислоты, и из металла основания, используемого для нейтрализации..
фосфаты
Фосфорная кислота (H3ПО4) является оксокислотным полипротоном, из которого получают большое количество солей. Используя KOH, чтобы нейтрализовать это и таким образом получить его соли, у вас есть:
H3ПО4 + KOH => KH2ПО4 + H2О
KH2ПО4 + КОН => К2HPO4 + H2О
К2HPO4 + КОН => К3ПО4 + H2О
КОН нейтрализует один из кислых протонов Н3ПО4, Подставляя катион K+ в калиевой кислой фосфатной соли (согласно традиционной номенклатуре). Эта реакция продолжается до тех пор, пока не будут добавлены те же эквиваленты KOH для нейтрализации всех протонов.
Тогда можно увидеть, что образуется до трех различных солей калия, каждая из которых имеет свои соответствующие свойства и возможные применения. Тот же результат может быть получен с использованием LiOH, давая фосфаты лития; или Sr (ОН)2, с образованием фосфатов стронция и т. д. с другими основаниями.
цитраты
Лимонная кислота — это трикарбоновая кислота, присутствующая во многих фруктах. Следовательно, он имеет три группы -COOH, что равно трем кислотным протонам. Опять же, как и фосфорная кислота, она способна генерировать три типа цитратов в зависимости от степени нейтрализации.
Таким образом, используя NaOH, получают моно-, ди- и тринатрийцитраты:
OHC3H4(СООН)3 + NaOH => OHC3H4(Кун) (COOH)2 + H2О
OHC3H4(Кун) (COOH)2 + NaOH => OHC3H4(COONa)2(COOH) + H2О
OHC3H4(COONa)2(COOH) + NaOH => OHC3H4(COONa)3 + H2О
Химические уравнения выглядят сложными, учитывая структуру лимонной кислоты, но представить ее можно так же просто, как реакции с фосфорной кислотой..
Последняя соль — нейтральный цитрат натрия, химическая формула которого — Na3С6H5О7. И другие цитраты натрия: Na2С6H6О7, цитрат натрия (или динатрия); и NaC6H7О7, дикислота цитрат натрия (или цитрат натрия).
Это яркий пример солей органических кислот.
Химические свойства комплексных солей (на примере соединений алюминия и цинка)
В рамках программы ЕГЭ по химии следует усвоить химические свойства таких комплексных соединений алюминия и цинка, как тетрагидроксоалюминаты и третрагидроксоцинкаты.
Тетрагидроксоалюминатами и тетрагидроксоцинкатами называют соли, анионы которых имеют формулы [Al(OH)4]— и [Zn(OH)4]2- соответственно. Рассмотрим химические свойства таких соединений на примере солей натрия:
Данные соединения, как и другие растворимые комплексные, хорошо диссоциируют, при этом практически все комплексные ионы (в квадратных скобках) остаются целыми и не диссоциируют дальше:
Действие избытка сильной кислоты на данные соединения приводит к образованию двух солей:
При действии же на них недостатка сильных кислот в новую соль переходит только активный металл. Алюминий и цинк в составе гидроксидов выпадают в осадок:
Осаждение гидроксидов алюминия и цинка сильными кислотами не является удачным выбором, поскольку сложно добавить строго необходимое для этого количество сильной кислоты, не растворив при этом часть осадка. По этой причине для этого используют углекислый газ, обладающий очень слабыми кислотными свойствами и благодаря этому не способный растворить осадок гидроксида:
В случае тетрагидроксоалюмината осаждение гидроксида также можно проводить, используя диоксид серы и сероводород:
В случае тетрагидроксоцинката осаждение сероводородом невозможно, поскольку в осадок вместо гидроксида цинка выпадает его сульфид:
При упаривании растворов тетрагидроксоцинката и тетрагидроксоалюмината с последующим прокаливанием данные соединения переходят соответственно в цинкат и алюминат:
Огурцы с лимонной кислотой и болгарским перцем
 Потребуется на 1 банку 0,5 литра:
Потребуется на 1 банку 0,5 литра:
- 2 кольца лука
- 4 полоски сладкого перца
- 1 чайная ложка горчицы
- Корень хрена
- Укроп (зонтики)
- 2-3 зубчика чеснока
Маринад:
- 1 литр воды
- 1 столовая ложка соли
- 6 столовых ложек сахара
- 1 чайная ложка лимонной кислоты
В каждую банку положить:
- 1-2 кольца лука;
- Чайную ложку семян горчицы;
- Несколько кусочков корня хрена;
- Зонтики укропа;
- 2-3 зубчика чеснока.
 Уложить огурцы. Между ними – полоски перца. Болгарский сладкий перец полосками. Один плод разрезать на 6-8 частей в зависимости от размера.
Уложить огурцы. Между ними – полоски перца. Болгарский сладкий перец полосками. Один плод разрезать на 6-8 частей в зависимости от размера.
 Залить горячим рассолом. Прикрыть крышками.
Залить горячим рассолом. Прикрыть крышками.
Поставить на пастеризацию. Пастеризовать до 5 минут после закипания воды в кастрюле.
Герметично закатать. Перевернуть вниз горлышком. Оставить так пока остынут, прикрыв полотенцем.
Соли мочевой кислоты – ураты
Наличие этих соединений в моче – уратурия – вызывается нарушениями белкового обмена. В моче обнаруживаются мелкие коричнево-жёлтые кристаллы или желтоватые бесформенные сгустки.
Причины уратурии:
- Употребление продуктов, вызывающих образование мочевой кислоты.
- Жесткие диеты, основанные на употреблении большого объема фруктов, овощей и зелени. Эти продукты содержат пурины – вещества, из которых образуются ураты.
- Нарушение кровообращения в почках и проходящих через них сосудах.
- Обезвоживание, вызванное отравлениями и инфекциями, сопровождающимися рвотой и диареей.
- Токсикоз беременных.
- Различные патологии – сахарный диабет, недостаточность работы щитовидной железы, нарушения функции печени и почек, некоторые раковые опухоли.
- Неблагоприятная наследственность – у больных часто есть близкие родственники, страдающие таким же нарушением.
Высокая концентрация уратов указывает на высокий риск возникновения подагры. Это заболевание сопровождается воспалением суставов кистей и стоп, приводя к образованию наростов – тофусов.
Повышенная концентрация уратов в моче приводит к образованию уратных камней (конкрементов).
Методы получения[править | править код]
Существуют различные методы получения солей:
Взаимодействие кислот с металлами, основными и амфотерными оксидами / гидроксидами:
H2SO4+MgO⟶MgSO4+H2O{\displaystyle {\mathsf {H_{2}SO_{4}+MgO\longrightarrow MgSO_{4}+H_{2}O}}}
3H2SO4+Al2O3⟶Al2(SO4)3+3 H2O{\displaystyle {\mathsf {3H_{2}SO_{4}+Al_{2}O_{3}\longrightarrow Al_{2}(SO_{4})_{3}+3\ H_{2}O}}}
Взаимодействие кислотных оксидов c щелочами, основными и амфотерными оксидами / гидроксидами:
Ca(OH)2+CO2⟶CaCO3↓+H2O{\displaystyle {\mathsf {Ca(OH)_{2}+CO_{2}\longrightarrow CaCO_{3}\downarrow +H_{2}O}}}
CaO+SiO2⟶CaSiO3{\displaystyle {\mathsf {CaO+SiO_{2}\longrightarrow CaSiO_{3}}}}
Al2O3+3 SO3⟶Al2(SO4)3{\displaystyle {\mathsf {Al_{2}O_{3}+3\ SO_{3}\longrightarrow Al_{2}(SO_{4})_{3}}}}
Mg(OH)2+CO2⟶MgCO3↓+H2O{\displaystyle {\mathsf {Mg(OH)_{2}+CO_{2}\longrightarrow MgCO_{3}\downarrow +H_{2}O}}}
Zn(OH)2+SO3⟶ZnSO4+H2O{\displaystyle {\mathsf {Zn(OH)_{2}+SO_{3}\longrightarrow ZnSO_{4}+H_{2}O}}}
Взаимодействие солей c кислотами, другими солями (если образуется выходящий из сферы реакции продукт):
CuCl2+Na2S⟶2NaCl+CuS↓{\displaystyle {\mathsf {CuCl_{2}+Na_{2}S\longrightarrow 2NaCl+CuS\downarrow }}}
Взаимодействие простых веществ:
Fe+S⟶FeS{\displaystyle {\mathsf {Fe+S\longrightarrow FeS}}}
Взаимодействие оснований с неметаллами, например, с галогенами:
Ca(OH)2+Cl2⟶Ca(OCl)Cl+H2O{\displaystyle {\mathsf {Ca(OH)_{2}+Cl_{2}\longrightarrow Ca(OCl)Cl+H_{2}O}}}
Кристаллогидраты обычно получают при кристаллизации соли из водных растворов, однако известны также кристаллосольваты солей, выпадающие из неводных растворителей (например, CaBr2·3 C2H5OH).
Значение морской соли для организма
Соль, добываемая из морских глубин, обладает уникальными качествами. В лабораторных условиях ученые до сих пор не смогли вывести ее аналог, несмотря на то, что состав кристалла давно известен. Эзотерики утверждают, что соль, получаемая из морской воды, обладает большой силой природной энергии, которая наполняет организм человека гармонией и здоровьем .
Испокон веков хлористый натрий использовали как природный консервант, увеличивающий срок годности продуктов. На его основе готовили составы для продления молодости и красоты.
Влияние соли на организм человека:
- регулирует и поддерживает в пределах нормы водный баланс, натрий-калиевый ионный обмен;
- избавляет от спазмов гладкой мускулатуры;
- снабжает организм макро- и микроэлементами, в частности натрием;
- успокаивает нервную систему;
- способствует синтезу соляной кислоты;
- тормозит гнилостные процессы в ЖКТ (за счет антисептических свойств);
- ускоряет метаболизм;
- способствует формированию клеточных оболочек, образованию эритроцитов;
- поддерживает нормальный гормональный, липидный обмен, функцию половых желез;
- улучшает состояние кожных покров.
Соль выступает противоаллергическим, дезинфекционным агентом. Ее полезно не только употреблять внутрь, но и использовать наружно в качестве ванн, ингаляций, в составе масок. Так, соляные компрессы под глаза избавляют от мешков, полоскания с добавлением соды снимают воспаления миндалин, а ванночки избавляют от отека ног .
Ароматные хрустящие консервированные огурцы с лимонной кислотой
Потребуется на литровую банку:
- 1 щепотка корня хрена
- 1-2 вишневых листа
- 1-2 зубчика чеснока
- 1 смородиновый лист
- 1 зонтик укропа
- 1 веточка петрушки
- 5-6 горошин горького перца
- 2-3 штуки душистого перца
- 3-4 колечка перца чили по желанию
Для маринада:
- 3 литра воды
- 1 стакан сахара
- 3 столовые ложки соли
- 3 чайные ложки лимонной кислоты
 Отобранные для маринования на зиму огурцы залить холодной водой. Оставить на 3-4 часа, поменяв воду 1-2 раза за это время.
Отобранные для маринования на зиму огурцы залить холодной водой. Оставить на 3-4 часа, поменяв воду 1-2 раза за это время.
Затем тщательно вымыть, отрезать кончики.
Переложить в чистый эмалированный таз или большую кастрюлю. Вскипятить воду и залить огурцы.
Накрыть крышкой, сверху банным полотенцем, махровым халатом. Оставить на полчаса.
На дно чистых подготовленных банок уложить пряности и специи. Слить воду и уложить огурцы в банки.
Приготовить маринад. Довести необходимое для заливки воды до кипения. Всыпать соль и сахар. Дать вскипеть 2-3 минуты.
Добавить лимонную кислоту. Даем вскипеть и сразу заливаем банки с огурцами.
Закатать. Перевернуть вниз горлышком. Накрыть чем-то теплым, чтобы остывали постепенно.
3 литра рассола хватит приблизительно на 6-7 литровых банок.






