Этиловый эфир
Содержание:
Действие и эффект
Эфир одурманивает разум, заставляя его находиться словно в забытье и в тумане,поэтому любители его так же называют-наркотик гипноз.После употребления наркотика человек получает наркотическое опьянение, которое продолжается в среднем минут 15. Эфир применяется наркоманами для получения эйфории, общего возбуждения, которое сочетается со слуховыми и зрительными галлюцинациями. Но притупление разума, чувство отрешенности и тревоги может присутствовать еще на протяжении нескольких дней.
Эфир воздействует на человека поэтапно:
- Происходит общее обезболивание всего организма. Наступает лёгкое опьянения эфиром в связи с чем исчезает болевая чувствительность. Но при этом сознание остается ясным.
- Возбуждение. Происходит помутнение сознания с сильным возбуждением. Увеличивается физическая активность,повышается тонус мышц,повышается давление и учащается пульс, появляется кашель.
- Стадия хирургического наркоза. Происходит угнетение нервной системы,потеря сознания-состояние гипноза. А далее наступает спокойствие и жизненные показатели приходят в норму.
Химические свойства
Этиловый эфир уксусной кислоты – типичный алифатический простой эфир. Молекулярная масса = 74,1 грамма на моль. Вещество также называют: этиловый, серный эфир. Это жидкость без цвета, подвижная и очень прозрачная, обладает специфическим запахом и вкусом. Формула этилового эфира: C4H10O. Вещество плохо растворяется в воде, образует с ней азеотропную смесь. Свободно смешивается с бензолом, жирными маслами, этиловым спиртом. Соединение летуче и легко воспламеняется, является взрывоопасным при соединении с кислородом или воздухом. Препарат для наркоза содержит порядка 96-98% вещества, плотность медицинского эфира составляет 0,715. Средство закипает при 35 градусах Цельсия.
Структурная формула Диэтилового Эфира: СН3-СН2-О-СН2-СН3. У вещества имеются гомологи и изомеры. Изомером Диэтилового Эфира является: метилпропиловый (СН3-СН2-СН2-О-СН3) и метилизопропиловый эфиры. Формула этилового эфира пропионовой кислоты: С5Н10О2. Химическая формула этилового эфира уксусной кислоты: СН3-СОО-CH2-CH3.
Вещество разлагается под действием тепла, воздуха и света, образуя токсичные альдегиды, кетоны и пероксиды. Также соединение обладает всеми химическими свойствами, которые характерны для простых эфиров, образует оксониевые соли и комплексные соединения.
Получение Диэтилового Эфира. Вещество можно синтезировать при действии кислотных катализаторов на этиловый спирт. Например, Диэтиловый Эфир получается при перегонке серной кислоты и этилена при высоких температурах (порядка 140-150 градусов). Соединение также может образоваться в форме побочного продукта в гидратации этилена с уксусной или серной кислотой при соответствующем давлении и температуре.
- Средство получило широкое применение в медицине;
- используется в качестве растворителя нитратов целлюлозы при производстве бездымного порока, синтетических и природных смол, алкалоидов;
- при производстве топлива для авиамодельных двигателей;
- применяется для бензиновых двигателей внутреннего сгорания при низкой температуре;
- вещество используют при переработке ядерного топлива в качестве экстреганта для разделения плутония и его продуктов деления, урана из руды и так далее.
Литература[править | править код]
- Бабаян Э. А., Гаевский А. В., Бардин Е. В. «Правовые аспекты оборота наркотических, психотропных, сильнодействующих, ядовитых веществ и прекурсоров» М.: МЦФЭР, 2000 стр. 148
- Гурвич Я. А. «Справочник молодого аппаратчика-химика» М.: Химия, 1991 стр. 229
- Девяткин В. В., Ляхова Ю. М. «Химия для любознательных, или о чём не узнаешь на уроке» Ярославль: Академия Холдинг, 2000 стр. 48
- Рабинович В. А., Хавин З. Я. «Краткий химический справочник» Л.: Химия, 1977 стр. 148
- Гауптман 3., Органическая химия, пер. с нем., М.: Химия, 1979, с. 332-40;
- Грефе Ю., Общая органическая химия, пер. с англ., т. 2, М., 1982, с. 289—353;
- Ремане X.,Kirk-Othmer encyclopedia, v. 9, N. Y., 1980, p. 381-92.
История
Возможно, что впервые диэтиловый эфир был получен в IX веке алхимиком Джабир ибн Хайяном либо алхимиком Раймундом Луллием в 1275 году. Достоверно известно, что он был синтезирован в 1540 году Валерием Кордусом, который назвал его «сладким купоросным маслом» (лат. oleum dulce vitrioli), поскольку получил его перегонкой смеси этилового спирта и серной кислоты, которая тогда называлась «купоросным маслом». Кордус также отметил его анестезирующие свойства. В 1680 году Роберт Бойль вторично синтезировал эфир. Затем в 1704 году Исаак Ньютон открыл эфир в третий раз, в поисках синтеза искусственного золота.
Название «эфир» было дано этому веществу в 1729 году Фробениусом.
В 1794 году эфир был испытан для вдыханий с целью уменьшения болей, а в 1795 году Томас Беддоус создал Медицинский пневматический институт для лечения различных легочных заболеваний газами. Такие газы тогда называли «искусственным воздухом».
Номенклатура
В системе номенклатуры IUPAC простые эфиры названы с использованием общей формулы «алкоксиалкан» , например, CH 3 –CH 2 –O – CH 3 представляет собой метоксиэтан . Если эфир является частью более сложной молекулы, он описывается как алкокси-заместитель, поэтому -OCH 3 будет считаться « метокси -» группой. Более простой алкильный радикал написан впереди, поэтому CH 3 –O – CH 2 CH 3 будет дан как метокси (CH 3 O) этан (CH 2 CH 3 ).
Банальное имя
Для простых эфиров часто не соблюдаются правила IUPAC. Тривиальные названия простых эфиров (то есть тех, которые не содержат или не содержат других функциональных групп) представляют собой смесь двух заместителей, за которыми следует «эфир». Например, этилметиловый эфир (CH 3 OC 2 H 5 ), дифениловый эфир ( C 6 H 5 OC 6 H 5 ). Что касается других органических соединений, очень распространенные эфиры получили названия до того, как были формализованы правила номенклатуры. Диэтиловый эфир называют просто «эфиром», но когда-то его называли сладким купоросным маслом . Метилфениловый эфир — это анизол , потому что он изначально был найден в анисе . В ароматические простые эфиры включают фураны . Ацетали (α-алкоксиэфиры R – CH (–OR) –O – R) — еще один класс простых эфиров с характерными свойствами.
Полиэфиры
Полиэфиры обычно представляют собой полимеры, содержащие простые эфирные связи в их основной цепи. Термин гликоль обычно относится к полиэфирполиолам с одной или несколькими функциональными концевыми группами, такими как гидроксильная группа. Термин «оксид» или другие термины используются для полимера с высокой молекулярной массой, когда концевые группы больше не влияют на свойства полимера.
Краун-эфиры — это циклические полиэфиры. Некоторые токсины, вырабатываемые динофлагеллятами, такие как бреветоксин и сигуатоксин, имеют чрезвычайно большие размеры и известны как циклические или лестничные полиэфиры.
| Название полимеров с молярной массой от низкой до средней | Название полимеров с высокой молярной массой | Подготовка | Повторяющийся блок | Примеры торговых наименований |
|---|---|---|---|---|
| Параформальдегид | Полиоксиметилен (ПОМ) или полиацеталь или полиформальдегид | Шаг роста полимеризации из формальдегида | –CH 2 O– | Делрин от DuPont |
| Полиэтиленгликоль (ПЭГ) | Полиэтиленоксид (PEO) или полиоксиэтилен (POE) | Полимеризации с раскрытием кольца из окиси этилена | –CH 2 CH 2 O– | Carbowax от Dow |
| Полипропиленгликоль (PPG) | Оксид полипропилена (PPOX) или полиоксипропилен (POP) | анионная полимеризация с раскрытием кольца пропиленоксида | –CH 2 CH (CH 3 ) O– | Аркол из Ковестро |
| Политетраметиленгликоль (PTMG) или политетраметиленэфиргликоль (PTMEG) | Политетрагидрофуран (ПТГФ) | Катализируемая кислотой полимеризация тетрагидрофурана с раскрытием цикла |
–CH2CH2CH2CH2O– | Тератан от Invista и PolyTHF от BASF |
Полимеры фенилового эфира представляют собой класс ароматических простых полиэфиров, содержащих ароматические циклы в их основной цепи: полифениловый эфир (PPE) и поли ( п- фениленоксид) (PPO).
Родственные соединения
Многие классы соединений со связями C – O – C не считаются простыми эфирами: сложные эфиры (R – C (= O) –O – R ′), полуацетали (R – CH (–OH) –O – R ′), карбоновые кислоты. ангидриды (RC (= O) –O – C (= O) R ′).
Как его используют в медицине?
Изначально диэтиловый эфир использовался для анестезии, поскольку его влияние на нейроны мозга и уникальное свойство «обездвиживать» центральную нервную систему полностью обратимо (при условии применения небольших по объему дозировок).
В дальнейшем вещество применялось только для ингаляционного наркоза при осуществлении хирургических вмешательств. В чистой форме диэтиловый эфир никогда не использовался, поскольку он обладает множеством побочных эффектов.
Эфир широко применяется в медицине, поскольку обеспечивает:
- повышение кровоточивости капилляров,
- угнетение перистальтики кишечника,
- угнетение секреторной функции ЖКТ.
В менее очищенном варианте вещество применяется для растираний и приготовления настоек и экстрактов. Иногда диэтиловый спирт назначается в качестве рефлекторно-возбуждающего средства внутрь при рвоте и икоте.
Синтез эфира
Синтез эфира Вильямсона
Для простых эфиров возможны различные пути синтеза . Вероятно, наиболее известным механизмом является синтез эфира Вильямсона . Здесь, в щелочных — алкогол с галогеналканом реализован, в котором в дополнение к соответствующему щелочного металла галогена — соли (не показан), образуется эфир.
Синтез эфира Вильямсона. R, R ‘= алкильные радикалы, X = атом галогена.
Реакция протекает по механизму и используется для получения простых и смешанных эфиров. может происходить как побочная , поэтому применение синтеза эфира Вильямсона с третичными галогеналканами не имеет смысла.
Синтез эфира Вильямсона приводит к циклическим эфирам во внутримолекулярной реакции. Самый простой представитель этого класса — оксациклопропан ( окись этилена , оксиран); Самый известный представитель — тетрагидрофуран (THF), популярный растворитель в органической химии.
Кислотно-катализируемая конденсация спиртов
При кислотном катализе (здесь серная кислота ) две молекулы спирта (показаны на примере этанола ) могут быть сконденсированы до простого эфира (здесь диэтилового эфира ) с удалением воды :
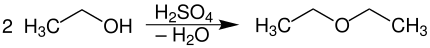
Если используется только один тип спирта (здесь этанол), симметричные эфиры (R — O — R) могут быть представлены таким образом. Если смеси з. Например, два спирта (например, R 1 –OH и R 2 –OH) могут образовывать три разных эфира под действием серной или фосфорной кислоты :
R 1 –O — R 1 (симметричный эфир)
R 2 –O — R 2 (симметричный эфир)
R 1 –O — R 2 (несимметричный эфир)
Присоединение спиртов к двойным связям
Спирты могут присоединяться к двойным связям , при этом протон добавляемой кислоты сначала электрофильно присоединяется к двойной связи. Затем спирт накапливается нуклеофильным образом , и после последующего депротонирования образуется эфир:
Присоединение спиртов к двойным связям. R = алкильные остатки, водород (если применимо, соблюдать правило Марковникова ).
Структура этилацетата
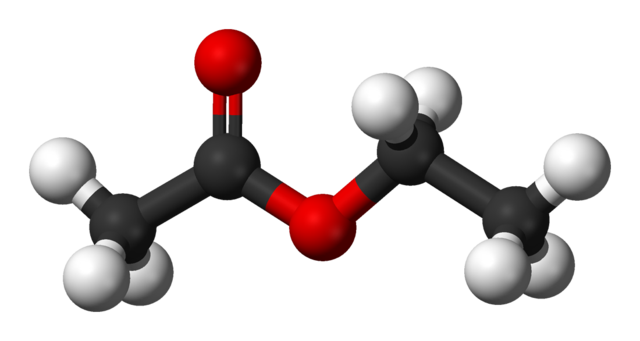
На верхнем изображении показана структура этилацетата в виде сферы и стержня. В этой модели атомы кислорода выделены красными сферами; слева — фракция, полученная из кислоты, а справа — фракция, полученная из спирта (алкоксигруппа, –OR).
Карбонильная группа видна по связи C = O (двойные полосы). Структура вокруг этой группы и соседнего кислорода плоская из-за того, что происходит делокализация заряда за счет резонанса между обоими атомами кислорода; факт, который объясняет относительно низкую кислотность α-атомов водорода (группы –CH 3 , связанной с C = O).
Вращая две свои связи, молекула напрямую способствует тому, как она взаимодействует с другими молекулами. Наличие двух атомов кислорода и асимметрия в структуре придают ей постоянный дипольный момент; что, в свою очередь, отвечает за их диполь-дипольные взаимодействия.
Например, электронная плотность выше около двух атомов кислорода, значительно снижаясь в группе –CH 3 и постепенно в группе OCH 2 CH 3 .
Из-за этих взаимодействий молекулы этилацетата при нормальных условиях образуют жидкость со значительно высокой температурой кипения (77 ° C).
Простые эфиры
Простыми эфирами называют органические вещества, в которых два углеводородных радикала связаны атомом кислорода: R’–O–R», где R’ и R» — различные или одинаковые радикалы.
Простые эфиры могут быть предельными, непредельными, циклическими, ароматическими.
предельные
непредельные
ароматические
циклические
Простые эфиры рассматриваются как производные спиртов. Названия этих соединений строятся из названий радикалов (в порядке возрастания молекулярной массы) и слова «эфир». Например, CH3-O-CH3 — диметиловый эфир; C2H5-O-CH3 — метилэтиловый эфир.
Физические свойства
Два первых простейших представителя – диметиловый и метилэтиловый эфиры – при обычных условиях газы, все остальные – жидкости.
Диэтиловый эфир (C2H5-O-C2H5)– бесцветная легкокипящая прозрачная жидкость (t кип. 35,5 °С), малорастворимая в воде. С этиловым спиртом смешивается в любых отношениях. Температура воспламенения – 9,4°С, образует с воздухом взрывоопасную смесь. Вызывает набухание резин. Широко применяется в качестве растворителя, в медицине (ингаляционный наркоз), вызывает привыкание человека, ядовит.
Диоксан (т. кип. 101°С) — хороший растворитель, смешивается как с водой, так и с углеводородами. За эти качества его назвали «органической водой». Достаточно токсичен. Значительно более опасны галогенсодержащие дибензопроизводные диоксана: диоксин (2,3,7,8-тетрахлордибензо-п-диоксин).
Простые эфиры имеют более низкие температуры кипения и плавления, чем изомерные им спирты. Эфиры практически не смешиваются с водой. Это объясняется тем, что простые эфиры не образуют водородных связей, т.к. в их молекулах отсутствуют полярные связи О-Н.
Простые эфиры хорошо растворяют многие органические вещества и поэтому часто используются как растворители.
Эфиры имеют приятный запах.
Химические свойства
Простые эфиры — малоактивные соединения, они значительно менее реакционноспособны, чем спирты.
1.Расщепление простых эфиров HJ и HBr
Простые эфиры разлагаются под действием концентрированных иодоводородной или бромоводородной кислот:
2. Образование комплексных соединений
Образование нестойких солей оксония (подобных солям аммония) в результате взаимодействия с сильными кислотами:
3. Окисление эфиров, образование перекисей
Несмотря на относительную химическую инертность, эфиры легко образуют при хранении на воздухе перекиси:
Перекиси являются причиной взрывов в конце перегонки эфиров, поэтому эфиры тщательно очищают от перекисей перед перегонкой и применением.
Получение
1. Межмолекулярная дегидратация спиртов
Симметричные простые эфиры R–O–R получают при межмолекулярной дегидратации спиртов:
При этом в одной молекуле спирта разрывается связь О-Н, а в другой — связь С-О. Реакцию можно рассматривать как нуклеофильное замещение группы HО– (в одной молекуле спирта) на группу RO– (от другой молекулы):
2. Взаимодействие галогенпроизводных с алкоголятами (реакция Вильямсона)
Эфиры несимметричного строения R–O–R’ образуются при взаимодействии алкоголята и галогенуглеводорода. Например, метилэтиловый эфир можно получить из этилата натрия и хлорметана:
В этой реакции происходит нуклеофильное замещение галогена (Cl–) на алкоксигруппу (CH3O–):
3. Дегидратация спиртов в присутствии ионов водорода как катализаторов
4. Получение гетероцикических кислородсодержащих соединений (циклические простые эфиры) этиленоксид (эпоксид) диоксан
Применение
Вследствие относительной химической инертности, эфиры часто применяются в качестве органических растворителей (диэтиловый эфир, тетрагидрофуран, диоксан).
Эфиры с разветвленными алкильными радикалами (например, метил-трет-бутиловый эфир) используются в последнее время в качестве антидетонационных добавок в моторные топлива (бензины), заменяя чрезвычайно вредный тетраэтилсвинец (ТЭС) — Pb (CH3CH2)4.
Простые эфиры фенолов и нафтолов имеют своеобразные запахи и применяются в парфюмерии.
Рубрики: Эфиры Теги: Эфиры
Этиловый эфир
Этиловый эфир выпускают согласно ГОСТ 6265 — 52 следующих марок: технический, медицинский и медицинский для наркоза.
Этиловые эфиры образуются количественно по отношению к кислотам. Они представляют собой бесцветную, прозрачную жидкость со специфическим запахом, характерным для легких эфиров. Температура выкипания-120 — 180 С, удельный вес при 20 С-082. Эти эфиры хорошо растворяют нитроцеллюлозу, глифтале-вые, поливинилхлоридные и алкидные смолы.
Этиловый эфир обладает низкой температурой самовоспламенения ( 180 — 200 С при атмосферном давлении), высоким давлением насыщенных паров и широкими пределами воспламеняемости. Снижение температуры сжатия от 300 до 190 — 220 СС при впрыске этилового эфира позволяет запустить двигатель при температуре примерно на 50 С ниже, чем на топливе. Однако при введении чистого эфира наблюдается высокая скорость нарастания давления в цилиндре двигателя, что может привести к поломкам деталей двигателя. Поэтому для смягчения жесткости работы двигателя в состав пусковых жидкостей, помимо масла, согласно патентным описям вводятся такие компоненты, как альдегиды, более высококипящие эфи-ры, амины, нитриты, нитраты, а также парафиновые углеводороды, преимущественно низкокипящие, и другие соединения. В результате этого содержание этилового эфира в пусковых жидкостях, как правило, не превышает 60 — 70 % и поэтому эффективность их несколько снижается.
Этиловый эфир пировипоградпой кислоты ( СНзССОС Н5) образует кеталь легче, чем ацетон.
Этиловый эфир — бесцветная, весьма подвижная и летучая жидкость со своеобразным приятным запахом. Смешивается с этанолом, бензолом, хлороформом и многими другими органическими растворителями. Растворимость в 100 мл воды — 7 5 г. С водой образует постоянно кипящую смесь при 34 15 С, содержащую 1 3 % воды.
Этиловый эфир 1-цианкоричнои кислоты О, О-Дибутилбутадиен — 1 3-фосфонат О.
Этиловый эфир 1-циан — 2-винилциклопропан — 1-кар-боновой кислоты, этиловый эфир 2-имино — З — циан-4 — винилциклопентан-1 — карбоновой кислоты и этиловый эфир 2-имино — 3-циан — 5-винилцикло-пентан — 1-карбоновой кислоты С.
Этиловый эфир ( C2Hs) 2O называется иногда обыкновенным, или серным, эфиром.
Этиловый эфир находит разностороннее применение, особенно в качестве хорошего растворителя. В медицине его употребляют для наркоза и усиления сердечной деятельности.
Этиловый эфир применяется для наркоза.
Этиловый эфир n — аминобензойной кислоты применяется в качестве анестезирующего средства под названием анестезина.
Этиловый эфир является важнейшим растворителем в практике лабораторного органического синтеза и в производствах тонких органических продуктов. Его применяют также в больших количествах в смеси с этиловым спиртом для растворения нитроцеллюлозы и в производствах бездымного пороха, коллодия и кинопленки. Имеет широкое применение и в медицине.
Этиловый эфир е / порично-бутилмалоновой кислоты удобно получать из бромистого шорично-бутила и малонового эфира по общему способу, описанному в Синт. Указанный выше выход р-метилвалериановой кислоты был получен при применении полученного данным способом этилового эфира ето / шчно-бутилмалоновой кислоты.
Этиловый эфир применять нельзя, так как его температура кипения близка к температуре кипения пентана.
Этиловый эфир р-фенил fi — оксипропионовой кислоты , В чистую сухую пол-литровую грехгорлую — колбу, сяаб жснную механической мешалкой, делительной воронт кой на 250 мл и обратным холодильником с хлоркальцне-вой трубкой, помещают 40 г ( 0 62 моля) очищенной цинковой пыли или гранулированного цинка, В делительную воронку наливают раствор 83 5 г ( 0 50 моля) бромуксусно-го эфира и 65 г ( 0 61 моля) бензальдегида в 80 мл сухого бензола и 20 мл абсолютного эфира.
номенклатура
Согласно номенклатуре IUPAC , алифатические простые эфиры называются алкоксиалканами: R 1 -O-R 2 , где группа O-R 2 рассматривается как алкоксизаместитель алкановой цепи R 1 . Заместителем более низкого ранга в цепи является алкоксильный радикал (–O — R 2 ), заместителем более высокого ранга является основа названия вещества. Имена, также одобренные IUPAC, образуются путем наименования двух алкильных радикалов и конечного эфира и особенно распространены для небольших алифатических простых эфиров. В случае симметричных эфиров, обозначение очень просто возможно, поставив перед ним Di . Почти все циклические и ароматические простые эфиры известны только под их общими названиями.
Прямые и разветвленные эфиры
Именование алкоксиалканов происходит соответственно. Примеры:
Соединение H 3 C-O-CH 3 состоит из заместителя H 3 C-O и метильного радикала (CH 3 ) в качестве основы, хотя здесь оба радикала эквивалентны. Соответственно, соединение называется метоксиметаном или диметиловым эфиром :
H 3 C — O — CH (CH 3 ) 2 называется 2-метоксипропаном или изопропилметиловым эфиром. Пропановая цепь более высокого ранга образует название стержня, к которому метокси-заместитель присоединен к 2- (или изо ) положению пропильного радикала:
FH 2 C-CH 2 -O-CH 2 -CH 3 обозначается как 1-этокси-2-фторэтан . В принципе, обе цепи имеют одинаковый ранг, но фторированный (и, следовательно, более высокозамещенный) остаток составляет основу названия:
Циклические эфиры
Циклические простые эфиры считаются циклоалканами, в которых один (или несколько) атомов углерода заменен (атомами) кислорода. Чтобы прояснить это, слог « Окса » вставлен в соответствующее место в соответствии с системой Ханча-Видмана . Пример:
Соединение приводится почти исключительно под названием тетрагидропиран , название IUPAC — оксациклогексан. Соединение является циклическим ( цикло ), имеет размер кольца 6 атомов ( гексан ), и в одном положении атом углерода заменен атомом кислорода ( окса ). Название 4-фтороксациклогексан или более часто используемое относится к следующему соединению, соответственно: 4-фтортетрагидропиран .
Структура этилового эфира
На изображении выше мы имеем представление с моделью сфер и стержней молекулярной структуры этилового эфира.
Как видно, красная сфера, соответствующая атому кислорода, имеет две этильные группы, связанные с обеих сторон. Все звенья простые, гибкие и свободно вращаются вокруг осей σ.
Эти вращения происходят из стереоизомеров, известных как конформеры; что больше, чем изомеры, они являются альтернативными пространственными состояниями. Структура изображения точно соответствует антиконформеру, в котором все его группы атомов расположены в шахматном порядке (отделены друг от друга).
Каким был бы другой конформер? Затмение, и хотя ваше изображение недоступно, просто визуализируйте его с помощью формы U. На верхних концах U будут расположены метильные группы -CH3, которые будут испытывать стерические отталкивания (они сталкиваются в космосе).
Следовательно, ожидается, что молекула СН3СН2ОСН2СН3 принять анти-конформации большую часть времени.
Межмолекулярные силы
Какими межмолекулярными силами управляют молекулы этилового эфира в жидкой фазе? Они поддерживаются в жидкости главным образом благодаря дисперсионным силам, поскольку в их дипольном моменте (1,5D) отсутствует область, достаточно дефицитная по электронной плотности (δ +).
Это потому, что ни один атом углерода в этильных группах не дает слишком много электронной плотности для атома кислорода. Сказанное выше видно на карте электростатического потенциала этилового эфира под рукой (нижнее изображение)
Обратите внимание на отсутствие синей области
Кислород также не может образовывать водородные связи, опять же, потому что в молекулярной структуре нет доступных О-Н связей. Следовательно, мгновенные диполи и их молекулярная масса способствуют их силам рассеивания..
Несмотря на это, он хорошо растворяется в воде. Почему? Поскольку его атом кислорода, с более высокой электронной плотностью, может принимать водородные связи от молекулы воды:
(СН3СН2)2Оδ- — δ+Н-ОН
Эти взаимодействия ответственны за растворение 6,04 г этого эфира в 100 мл воды..
состав
Структура и связь эфиров
Как правило, эфир можно использовать в качестве
- Р.1-О-Р.2 {\ Displaystyle \ mathrm {R ^ {1} {-} O {-} R ^ {2} \}}
быть представленным. R 1 и R 2 здесь представляют собой алкильные или арильные радикалы, которые в случае циклического простого эфира связаны друг с другом. Возможны также алкилариловые эфиры (см. Анизол и ванилин ). Связи в простых эфирах аналогичны отношениям в спиртах и в воде , которые можно рассматривать как основную структуру этих двух классов соединений. Каждый из атомов углерода и кислорода гибридизован sp 3 . Это приводит к тетраэдрическому расположению атомных орбиталей вокруг всех задействованных атомов. Угол связи кислорода расширился до 112 ° из — за более объемистыми алкильные заместитель по сравнению с водородом (104,5 ° в Н 2 О). Примерно при 143 C — O имеют же длину, как в спиртах.
Побочные действия
Со стороны сердечно-сосудистой системы и крови (кроветворение, гемостаз): тахикардия или брадикардия, вплоть до остановки сердца; аритмия; гипер- или гипотензия; коллапс; кровоточивость.
Со стороны органов ЖКТ: гиперсаливация, тошнота, рвота, понижение тонуса и моторики ЖКТ, паралитический илеус (при длительном наркозе), транзиторная желтуха, изменение печеночных проб.
Со стороны нервной системы и органов чувств: возбуждение, двигательная активность, редко — судороги у детей, сонливость, депрессия (после операции).
Прочие: метаболический ацидоз, гипоальбуминемия, гипогаммаглобулинемия, уменьшение выделения мочи, альбуминурия.
растворитель
Этилацетат используется в качестве растворителя и разбавителя при очистке печатных плат. Он используется в качестве растворителя при производстве модифицированного экстракта хмеля, а также для удаления кофеина из кофейных и чайных листьев. Он используется в чернилах, используемых для маркировки фруктов и овощей.
Этилацетат используется в текстильной промышленности как чистящее средство. Он используется при калибровке термометров, используемых при разделении сахаров. В лакокрасочной промышленности он используется в качестве растворителя и разбавителя используемых материалов.
Производство
Наиболее простой диэтиловый эфир получают в качестве побочного продукта в паровой фазе гидратации из этилена , чтобы сделать этанол . В этом процессе используются катализаторы на основе фосфорной кислоты на твердой основе, и при необходимости его можно отрегулировать для получения большего количества эфира. Парофазная дегидратация этанола на некоторых катализаторах на основе оксида алюминия может дать выход диэтилового эфира до 95%.
Диэтиловый эфир можно получить как в лабораториях, так и в промышленных масштабах путем синтеза кислого эфира. Этанол смешивают с сильной кислотой, обычно серной кислотой , H 2 SO 4 . Кислота диссоциирует в водной среде с образованием ионов гидроксония H 3 O + . Ион водорода протонирует на электроотрицательный атом кислорода в этаноле , давая молекуле этанола положительный заряд:
- СН 3 СН 2 ОН + Н 3 О + → СН 3 СН 2 ОН 2 + + Н 2 О
Нуклеофильный атом кислорода непротонированного этанола вытесняет молекулу воды от протонированного ( электрофильной ) молекулы этанола, производя воду, ион водорода и диэтиловый эфир.
- CH 3 CH 2 OH 2 + + CH 3 CH 2 OH → H 2 O + H + + CH 3 CH 2 OCH 2 CH 3
Эта реакция должна проводиться при температурах ниже 150 ° C, чтобы гарантировать, что продукт элиминирования ( этилен ) не является продуктом реакции. При более высоких температурах этанол дегидратируется с образованием этилена. Реакция образования диэтилового эфира обратима, поэтому в конечном итоге достигается равновесие между реагентами и продуктами. Получение хорошего выхода эфира требует, чтобы эфир был отогнан из реакционной смеси, прежде чем он превратится в этанол, используя принцип Ле Шателье .
Другая реакция , которая может быть использована для получения простых эфиров является синтезом эфира Williamson , в котором алкоксид (получает путь растворения щелочного металла в спирте , который будет использоваться) выполняет нуклеофильное замещение , при возникновении алкилгалогенида .






