Зачем убрали эфир из переодической системы элементов менделеева?
Содержание:
- Структура этилового эфира
- Синтез
- Применение в медицине и фармации
- Химические свойства
- Получение
- Строение этанола
- Фармакодинамика и фармакокинетика
- Теория эфира Менделеева
- Химические свойства
- Что мы узнали?
- Особенности номенклатуры
- Органическое происхождение R-COOR’
- Сферы применения
- Оценка рисков
- Ключевые нюансы
- Способы получения
- приложений
- Грибное царство
Структура этилового эфира
На изображении выше мы имеем представление с моделью сфер и стержней молекулярной структуры этилового эфира.
Как видно, красная сфера, соответствующая атому кислорода, имеет две этильные группы, связанные с обеих сторон. Все звенья простые, гибкие и свободно вращаются вокруг осей σ.
Эти вращения происходят из стереоизомеров, известных как конформеры; что больше, чем изомеры, они являются альтернативными пространственными состояниями. Структура изображения точно соответствует антиконформеру, в котором все его группы атомов расположены в шахматном порядке (отделены друг от друга).
Каким был бы другой конформер? Затмение, и хотя ваше изображение недоступно, просто визуализируйте его с помощью формы U. На верхних концах U будут расположены метильные группы -CH3, которые будут испытывать стерические отталкивания (они сталкиваются в космосе).
Следовательно, ожидается, что молекула СН3СН2ОСН2СН3 принять анти-конформации большую часть времени.
Межмолекулярные силы
Какими межмолекулярными силами управляют молекулы этилового эфира в жидкой фазе? Они поддерживаются в жидкости главным образом благодаря дисперсионным силам, поскольку в их дипольном моменте (1,5D) отсутствует область, достаточно дефицитная по электронной плотности (δ +).
Это потому, что ни один атом углерода в этильных группах не дает слишком много электронной плотности для атома кислорода. Сказанное выше видно на карте электростатического потенциала этилового эфира под рукой (нижнее изображение)
Обратите внимание на отсутствие синей области
Кислород также не может образовывать водородные связи, опять же, потому что в молекулярной структуре нет доступных О-Н связей. Следовательно, мгновенные диполи и их молекулярная масса способствуют их силам рассеивания..
Несмотря на это, он хорошо растворяется в воде. Почему? Поскольку его атом кислорода, с более высокой электронной плотностью, может принимать водородные связи от молекулы воды:
(СН3СН2)2Оδ- — δ+Н-ОН
Эти взаимодействия ответственны за растворение 6,04 г этого эфира в 100 мл воды..
Синтез
Эфиры могут быть получены множеством способов. Обычно простые алкиловые эфиры образуются легче, чем ариловые эфиры, а для более поздних видов часто требуются металлические катализаторы.
Синтез диэтилового эфира реакцией этанола и серной кислоты известен с 13 века.
Обезвоживание спиртов
Дегидратации из спиртов дает простые эфиры:
- 2 R – OH → R – O – R + H 2 O при высокой температуре
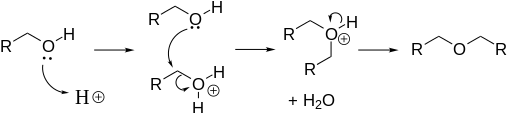
Эта реакция прямого нуклеофильного замещения требует повышенных температур (около 125 ° C). Реакция катализируется кислотами, обычно серной кислотой. Этот метод эффективен для получения симметричных простых эфиров, но не несимметричных простых эфиров, поскольку любой ОН может быть протонирован, что приведет к образованию смеси продуктов. Этим методом из этанола получают диэтиловый эфир. При таком подходе легко образуются циклические эфиры. Реакции элиминации конкурируют с обезвоживанием алкоголя:
- R – CH 2 –CH 2 (OH) → R – CH = CH 2 + H 2 O
Путь обезвоживания часто требует условий, несовместимых с хрупкими молекулами. Существует несколько более мягких методов производства эфиров.
Синтез эфира Вильямсона
Нуклеофильное замещение из алкилгалогенидов с помощью алкоксидов
- R – ONa + R′ – X → R – O – R ′ + Na X
Эта реакция называется синтезом эфира Вильямсона . Он включает обработку исходного спирта сильным основанием с образованием алкоксида с последующим добавлением соответствующего алифатического соединения, несущего подходящую уходящую группу (R – X). Подходящие уходящие группы (X) включают йодид , бромид или сульфонаты . Этот метод обычно не работает для арилгалогенидов (например, бромбензола , см. Конденсацию Ульмана ниже). Точно так же этот метод дает лучший выход только для первичных галогенидов. Вторичные и третичные галогениды склонны к элиминированию E2 под воздействием основного алкоксидного аниона, используемого в реакции, из-за стерических препятствий со стороны больших алкильных групп.
В родственной реакции алкилгалогениды подвергаются нуклеофильному замещению феноксидами . R – X нельзя использовать для реакции со спиртом. Однако фенолы можно использовать для замены спирта при сохранении галогенида алкила. Поскольку фенолы кислые, они легко реагируют с сильным основанием, таким как гидроксид натрия, с образованием ионов феноксида. Затем ион феноксида замещает группу –X в алкилгалогениде, образуя эфир с присоединенной к нему арильной группой в реакции с механизмом S N 2 .
- C 6 H 5 OH + OH — → C 6 H 5 –O — + H 2 O
- C 6 H 5 –O — + R – X → C 6 H 5 ИЛИ
Конденсация Ульмана
Конденсации Ульмана аналогична методе Williamson , за исключением того , что субстрат представляет собой арильный галогенид. Для таких реакций обычно требуется катализатор, например медь.
Электрофильное присоединение спиртов к алкенам
Спирты добавляют к электрофильно активированным алкенам .
- R 2 C = CR 2 + R – OH → R 2 CH – C (–O – R) –R 2
Для этой реакции требуется кислотный катализ . Часто, ртуть трифторацетат (Hg (OCOCF 3 ) 2 ) используются в качестве катализатора для реакции генерируя эфир с Марковниковым региохимией. Используя аналогичные реакции, тетрагидропираниловые эфиры используются в качестве защитных групп для спиртов.
Приготовление эпоксидов
Эпоксиды обычно получают окислением алкенов. Наиболее важным эпоксидом в промышленном масштабе является оксид этилена, который получают путем окисления этилена кислородом. Другие эпоксиды производятся одним из двух способов:
- Путем окисления алкенов пероксикислотой, такой как m- CPBA .
- Путем внутримолекулярного нуклеофильного замещения основания галогидрин.
Применение в медицине и фармации
Диэтиловый эфир применяют для изготовления настоев, экстрактов некоторых лекарственных форм для наружного применения, ограниченно — в хирургической практике для наркоза.
Его смесь с этанолом в пропорции 1: 3 под названием капель Гофмана используют при головокружении. Бутилвиниловый эфир является исходным продуктом синтеза поливинилбутилового эфира, который применяют при фурункулах, трофических язвах, ожогах, обморожениях (бальзам М.Ф. Шостаковского или винилин). К арилалкиловым эфирам можно отнести и димедрол, который применяют как антигистаминный препарат. Эфиры — растворители жиров, лаков и других органических соединений. Используются в производстве ароматических веществ, красителей.
Химические свойства
Для диэтилового эфира характерны все химические свойства простых эфиров. Итак, разберемся с этим вопросом подробнее. Это довольно инертное вещество. Основное отличие от сложных эфиров – отсутствие гидролиза, правда, есть и исключения. На холоде не взаимодействует с хлоридом фосфора, металлическим натрием и многими разбавленными минеральными кислотами. Несмотря на это, концентрированные кислоты (серная и йодоводородная) даже при низких температурах разлагают эти эфиры, а нагретый металлический натрий их расщепляет.
Эфир с неподеленными парами электронов взаимодействует с протоном сильной кислоты, в результате чего образуется неустойчивое оксониевое соединение:
— Ацидолиз. Серная и йодоводородная кислоты, а также FeCl3 в ангидриде уксусной кислоты способны расщеплять простые эфиры. Химическая реакция выглядит так: CH3—CH2—O—CH2—CH3 + HJ → CH3—CH2—OH + J—CH2—CH3.
— Реакция металлирования, получившая название реакции Шорыгина. Нагретый металлический натрий расщепляет диэтиловый эфир: C2H5–O–C2H5 + 2Na → C2H5ONa + C2H5Na
— Относительная химическая инертность не препятствует эфирам при хранении на воздухе образовывать перекиси, что зачастую приводит к взрывам в конце перегонки.
Получение
Сложные эфиры получают с помощью реакции этерификации из спиртов и карбоновых кислот:
CH3COOH + C2H5OH → CH3COOC2H5 + H2O.
Это наиболее важная реакция, которая обратима в ряде случаев: взаимодействуя с водой, образованный сложный эфир вновь распадается на начальные вещества.
Также сложные эфиры получают взаимодействием:
- ангидридов со спиртами:
(CH3CO)2O + 2C2H5OH → 2CH3COOC2H5 + H2O; - солей карбоновых кислот с галогенуглеводородами:
CH3(CH2)10COONa + CH3Cl → CH3(CH2)10COOCH3 + NaCl; - карбоновых кислот к алкенам:
CH3COOH + CH2=CH2 → CH3COOCH2CH3 + H2O.
При реакции этерификации от молекулы спирта отщепляется атом водорода, от кислоты – гидроксил.
Строение этанола
В молекулах спиртов, помимо связей С–С и С–Н, присутствуют ковалентные полярные химические связи О–Н и С–О.
| Электроотрицательность кислорода (ЭО = 3,5) больше электроотрицательности водорода (ЭО = 2,1) и углерода (ЭО = 2,4). |
Электронная плотность обеих связей смещена к более электроотрицательному атому кислорода:
Водородные связи и физические свойства спиртов
Спирты образуют межмолекулярные водородные связи. Водородные связи вызывают притяжение и ассоциацию молекул спиртов:
Поэтому этанол – жидкость с относительно высокой температурой кипения (температура кипения этанола +78 о С).
Водородные связи образуются не только между молекулами спиртов, но и между молекулами спиртов и воды. Поэтому спирты очень хорошо растворимы в воде. Молекулы спиртов в воде гидратируются:
| Чем больше углеводородный радикал, тем меньше растворимость спирта в воде. Чем больше ОН-групп в спирте, тем больше растворимость в воде. |
Этанол смешивается с водой в любых соотношениях.
Фармакодинамика и фармакокинетика
Вещество вступает в не специфическое взаимодействие с мембранами нейронов головного, спинного и продолговатого мозга, в основном – с липидными двухслойными мембранами аксонов. Лекарство обратимо изменяет механизмы их работы и ультраструктуру. Средство сильно угнетает работу центральной нервной системы, блокирует процессы синаптического возбуждения. Сохраняя активность бульбарных центров, вещество функционально дезинтегрирует взаимодействия коры и подкорки гм. После воздействия лекарства на человека отмечаются традиционные стадии наркоза: обезболивание, возбуждение и трехуровневый хирургический наркоз. У пациента отсутствует сознание и все виды чувствительности, угнетаются рефлекторные реакции, и расслабляется скелетная мускулатура.
При проведении премедикации с помощью Диэтилового Эфира в сочетании с прочими общими анестетиками (ингаляционными и нет) значительно снижается функциональная активность нейронов коры гм. У пациента развивается амнезия, повышается активность подкорковых образований, проявляется психомоторное возбуждение, вариабельность пульса, ЧСС и АД. Также вещество раздражает слизистые оболочки, в том числе в ротовой полости, вызывает гиперсаливацию, рост бронхиальной секреции, ларингоспазм и кашель, расстройства дыхания и работы сердечно-сосудистой системы. Если слюна или слизь, насыщенная эфиром проникает в пищеварительный тракт, у пациента происходит рефлекторная стимуляция рвотного центра, тошнота вначале наркоза и после пробуждения.
При проведении хирургического наркоза наблюдается значительное угнетение межнейрональной передачи импульсов в спинном и головном мозге. Происходит рост активности отделов гипоталамуса, отвечающих за работу гипофиза, симпатической нервной системы и надпочечников, повышается секреция катехоламинов и глюкокортикоидов. Стимулируется выброс адреналина, наблюдается гипергликемия, рост АД, спазм сосудов внутренних органов, угнетается перистальтика кишечника. У пациента расслабляются скелетные мышцы, нарушается центральная регуляция мышечного тонуса.
При применении больших дозировок лекарственного средства наблюдается угнетение дыхания, работы сосудодвигательного центра, гипотензия. Вещество стимулирует охлаждение легочных тканей при скоплении в ней жидкости, что может привести к пневмонии. Нарушаются обменные процессы, работа печени и почек, снижается диурез, сужаются почечные сосуды.
Следует отметить, что эфирный наркоз легко контролировать. При вдыхании паров через маску эффект развивается достаточно медленно, в течение 15-20 минут. Пробуждение от наркоза происходит в течение 20-40 минут. Достаточно долго сохраняется сонливость, угнетение работы нервной системы и обезболивающий эффект. При сочетании вещества с миорелаксантами и барбитуратами у пациента не возникает неприятных ощущений удушья и страха, снижается риск возникновения депрессии после наркоза.
Диэтиловый Эфир легко преодолевает ГЭБ, быстро проникает сквозь межнейронную жидкость и распределяется по внутренним органам. Наибольшая концентрация достигается в головном, спинном и продолговатом мозге. На стадии анальгезии плазменная концентрация составляет до 25 мг, возбуждения – до 70 мг, и в стадии хирургического наркоза – до 110 мг.
Средство быстро преодолевает плацентарный барьер, задерживается в гепатоцитах. Около 15% принятой дозировки подвергается биотрансформации. В первые несколько минут вещество быстро выводится из организма, затем процесс замедляется, порядка 90% средства выделяется с дыханием, остальное – с помощью почечной секреции.
При применении медицинского эфира для аппликации на ткани зуба, он оказывает подсушивающий эффект. Обладает слабой антибактериальной и местной обезболивающей активностью. При наружном применении средство оказывает местно раздражающий и охлаждающий эффекты.
Теория эфира Менделеева
Дмитрий Иванович Менделеев зашёл в тему эфира со стороны химии. В своей работе «Попытка химического понимания мирового эфира» великий русский химик описывает ход своих мыслей по созданию химических элементов частиц эфира.
Учёный пишет в своём труде, что “эфир — это легчайший — в этом отношении предельный — газ, обладающий высокою степенью проницаемости”, “его частицы имеют относительно малый вес и обладают высшею, чем для каких-либо иных газов, скоростью своего поступательного движения”. Поэтому учёный выделил эфир в отдельную — нулевую — колонку в своей таблице химических элементов (позже, после смерти Дмитрия Ивановича, эта таблица была обрезана как раз в этом месте).
Итак, Дмитрий Иванович разработал в рамках своей гипотезы два химических элемента, под которыми он подразумевал такое явление, как эфирное вещество. Первый вариант — “короний” (или “Y”) — он поместил в первый ряд нулевой группы. Второй вариант — “ньютоний” (или “X”) — химик вывел совершенно отдельно и поставил в нулевой ряд и нулевую группу.
“ЗАДАЧУ ТЯГОТЕНИЯ И ЗАДАЧИ ВСЕЙ ЭНЕРГЕТИКИ НЕЛЬЗЯ ПРЕДСТАВИТЬ реально решёнными БЕЗ РЕАЛЬНОГО ПОНИМАНИЯ ЭФИРА, как мировой среды, передающей энергию на расстояниях”, — заключает великий русский учёный.
И на этом месте мы переходим к следующему великому учёному славянского происхождения, который положил много лет своей жизни на опыты с эфиром, — к Николе Тесле.
Химические свойства
Свойства сложных эфиров и жиров обусловлены наличием в молекуле функциональной карбоксильной группы -COOH. Основные химические свойства эфиров представлены в таблице.
|
Реакция |
Описание |
Уравнение |
|
Гидролиз |
Обратная реакция этерификации – расщепление в водной среде на спирт и кислоту. При нагревании с водой в кислой среде разлагаются на кислоту и спирт. Эфиры «омыляются» под действием раствора щёлочи, образуя органическую соль и спирт. В этом случае реакция необратима |
|
|
Восстановление (гидрирование) |
При присоединении водорода сложные спирты восстанавливаются до спиртов |
СН3-СОО-CH2-CH3 (этилацетат) + 2H2 → 2C2H5OH (этанол) |
|
Присоединение (галогенирование) |
Реакция возможна при наличии в молекуле двойных связей. Атомы галогенов присоединяются к местам разрыва связей |
СН3СООСН=СН2 (виниловый эфир уксусной кислоты) + Br2 → Br-CH2-C H(Br)-COOH-CH2 |
|
Замещение |
При взаимодействии с аммиаком группа -СОН замещается аминогруппой. Образуются амид и спирт |
CH3-COO-CH3 (метилацетат) + NH3 → CH3-C(NH2)=O (амид уксусной кислоты) + CH3-OH (метанол) |
|
Горение |
При полном сгорании образуется углекислый газ и вода |
2CH3-COO-CH3 + 7O2 → 6CO2 + 6H2O |
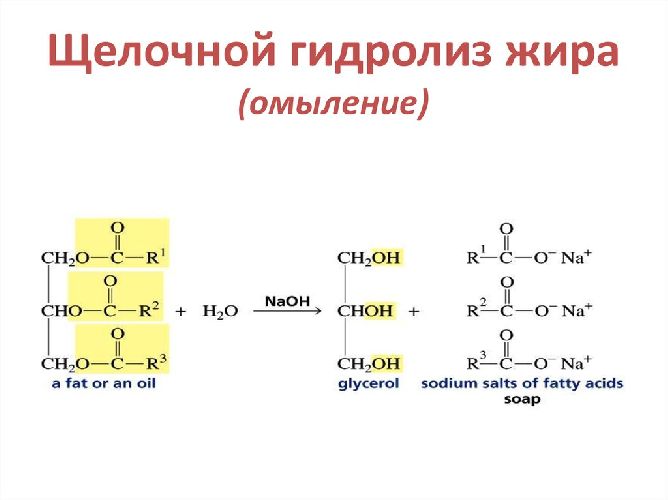
Рис. 2. Схема омыления жиров.
Сложные эфиры применяются в качестве ароматизаторов в медицине, парфюмерии, пищевой промышленности. Они входят в состав ягод, фруктов, пчелиного воска.

Рис. 3. Эфирные масла.
Что мы узнали?
Сложные эфиры в зависимости от строения являются жидкостями или твёрдыми веществами. Свойства соединений обуславливаются наличием карбоксильной группы -СООН. Сложные эфиры вступают в реакции горения, замещения, присоединения, восстановления. Под действием воды разлагаются на карбоновые кислоты и спирты (реакция обратная этерификации).
-
Вопрос 1 из 5
Начать тест(новая вкладка)
Особенности номенклатуры
Функциональные производные CH2O3 изучают на уроках химии в 10 классе. В научной среде существует несколько названий сложных эфиров:
- Сокращённый вариант. Если следовать систематической номенклатуре, тогда название эфира будет образовано следующим образом: на первом месте должно стоять наименование радикала, который присоединён к кислоте, потом следует корень слова с суффиксом «оат». Например, метилэтаноат, этилпропаноат. По сокращённому варианту также можно сформировать тривиальное название (используется суффикс «ат»). Например, бутират (CH3CH2CH2COOR), формиат (HCOOR), метилформиат (HCOOCH3), ацетат (C2H2), метилацетат (CH3COOCH3), этилформиат (НСООСН3), бутилацетат (СН3СООС4Н9), диметилсульфат (CH3SO4CH3), бутилпропионат (СН3СН2СООС4Н9). Дополнительно могут использоваться пропилформиат, пропилацетат и изопропилформиат.
- Стандартный, полный вариант. К имеющемуся названию радикала нужно прибавить суффикс «-ов-«, окончание «-ый» и слово «эфир». Например, R-COOR’ бутилпропионат в развёрнутом виде будет выглядеть следующим образом: бутиловый эфир пропионовой кислоты.
Если следовать правилам номенклатуры, тогда у одного и того же эфира может быть сразу 4 названия.
В химии широко используются тривиальные названия кислоты, которая входит в состав химического соединения. Но помимо наименования вещества нужно запомнить и структурную формулу. Например, изобутиловый эфир уксусной кислоты (CH3-COO-CH2-CH (CH3)2), амиловый эфир (С3Н7СООС5Н11).
Органическое происхождение R-COOR’
В составе многих фруктов, а также растений содержатся эфиры, которые придают им приятный аромат. Больше всего R-COOR’ в воске. Речь касается эфиров высших одноосновных кислот и одноатомных спиртов. К примеру, востребованный в народной и традиционной медицине пчелиный воск содержит в своём составе R-COOR’ мирицилового спирта и пальмитиновой кислоты. Химическая формула: СН3 (СН2)14 — С (О) — О — С31Н63. Эфиры на основе низших спиртов и кислот активно применяются в пищевой промышленности для изготовления различных фруктовых эссенций.
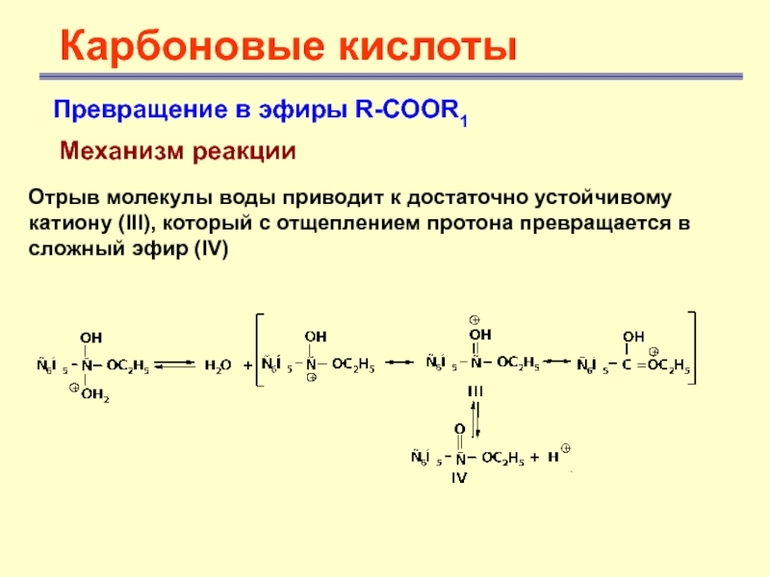
Основной способ синтеза R-COOR’ основан на взаимодействии спирта и карбоновой кислоты. Во время этой химической реакции выделяется вода. Чтобы добиться желаемого результата, из реакционной смеси дистиллируют Н2О. В результате многочисленных лабораторных исследований с применением меченых атомов удалось узнать много интересных фактов. В процессе синтеза атом О, который входит в состав образующейся воды, отрывается не от спирта, а от кислоты.
Название эфира может многое поведать о том, каким запахом будет обладать используемая масляная кислота:

- Метилбутират (C3H7 — COO — CH3) — яблоко.
- Амилформиат (H — COO — C5H11) — вишня.
- Изоамилформиат (H — COO — (СН2)2 — СНСН3 — CH3) — слива.
- Этилбутират (С3H7 — COO — C2H5) — ананас.
- Октилацетат (СH3 — COO — C3H17) — апельсин.
- Изобутилформиа (H — COO — СН2 — СНСН3 — CH3) — малина.
- Бутилбутират (С3H7 — COO — C4H9) — персик.
- Амилацетат (СH3 — COO — C5H11) — банан.
- Изомилацетат (СH3 — COO — (СГ2)2 — СНСН3 — CH3) — груша.
Дополнительно можно выделить уксусную кислоту (СН3СООН), метилформальдегид (C2H3OH). Взаимодействие солей CH2O3 с галоидалкиллами приводит к образованию R-COOR’.
Сферы применения
Сложные эфиры активно используются в косметологии, парфюмерии, для изготовления искусственных волокон, лаков, краски, клея, а также пищевых добавок. Метилпропионаты служат базовым компонентом в производстве многочисленных медикаментозных препаратов. Так как уксусные эфиры хорошо смешиваются со многими веществами органического происхождения, итоговый материал может использоваться как растворитель для краски и лака. Классический этилацетат и этилформиат является незаменимыми в современной промышленности. Специалисты используют их для быстрого растворения лаков на основе целлюлозы.
Поливинилацетатные смолы, а также клей невозможно получить без винилацетата. Если СЭ основаны на низшем метилацетате и кислотах, то их применяют в большой пищевой промышленности. С их помощью эксперты создают фруктовую эссенцию. Ароматические спирты нашли своё применение в парфюмерии (это духи, мыло, кремы). Стоит отметить, что СЭ являются базовым компонентом в сфере изготовления резины, пластмассы. Эксперты научились использовать эти вещества в качестве пластификаторов.

Из стандартных восков изготавливают:
- Многофункциональные смазки.
- Политуры.
- Средства пропитки для бумаги, а также кожи.
- Лекарственные препараты и мази.
- Косметику.
Промышленная категория

Многофункциональный бутилацетат хорошо зарекомендовал себя как высокоэффективный растворитель. После универсальной обработки средство может принимать вид некоторых лекарств, отдушек, а также препарата для дубления кожи. Немного иная картина с полисорбатом-80, который основан на натуральном оливковом масле. Это классический растворитель, специфический эмульгатор, промышленный модификатор показателя вязкости, смазка технического назначения, неионогенный ПАВ, стабилизатор, а также увлажнитель.
Твин-80 входит в состав универсальных растворов, которые предназначены для смазки и охлаждения. Если производство оборудовано необходимой техникой, тогда профессионалы изготавливают продукцию пищевого, масштабного косметического, промышленного сельскохозяйственного, бытового и даже технического назначения. Эфир выгодно отличается тем, что он может превращать смесь обычной воды и масла в своеобразную эмульсию.
Использование в медицине
Ещё в начале XX века, когда эксперты только начинали работать с органическим синтезом, фармакологи смогли испытать и синтезировать много сложных эфиров. За счёт этого они стали основой медикамента Валидол, Салол. В качестве обезболивающего и местно-раздражающего вещества был выпущен эффективный метилсалацетат, который сегодня практически вытеснен с обихода более результативными средствами.
Благодаря своим химическим свойствам малоновый эфир активно используется в традиционном синтезе для получения гетероциклических соединений, карбоновых и аминокарбоновых кислот. Диоктилфталат действует как репеллент.
Оценка рисков
В 2017 году диэтиловый эфир был включен в текущий план действий ЕС ( CoRAP ) в соответствии с Регламентом (ЕС) № 1907/2006 (REACH) в рамках оценки вещества . Здесь проводится повторная оценка воздействия на здоровье человека или окружающую среду и, при необходимости, предпринимаются последующие меры. Проглатывание диэтилового эфира было вызвано опасениями по поводу его использования потребителями , воздействия на окружающую среду , высокого (совокупного) тоннажа, других проблем, связанных с опасностями и широкого распространения, а также потенциальной опасности канцерогенных, мутагенных и репродуктивных свойств. Ожидается, что переоценка будет проведена Францией с 2020 года .
Ключевые нюансы
Для правильного оформления СЭ была разработана универсальная формула. Само название вещества состоит из двух основных фраз. В качестве основного радикала используется сам этанол, после чего к нему обязательно добавляют наименование кислоты. За счёт этого экспертам удалось создать следующие названия: изопропилметаноат, пропилметаноат, мелпропионат, этилацетат, этилбутират.

Распространённые эфиры глицерола и аналогичных жирных кислот высшей группы представлены специфическими химическими основами масел и жиров. Но, несмотря на этот факт, отдельные категории изопропилацетата химикам приходится синтезировать в лабораторных условиях. Это касается тех случаев, когда вещества встречаются редко либо находятся в ограниченном количестве. Эксперты самостоятельно устраняют все возникающие сложности.
Для электрофикации (синтеза) между распространёнными карбоновыми кислотами и спиртами нужен подходящий катализатор. Для этого специалисты могут использовать концентрированную серную кислоту. При правильном использовании она быстро активирует молекулы карбона. Итоговая скорость во многом зависит от того, с какими именно атомами углерода будет связана большая группа ОН. Огромное значение играет химическая природа спирта и кислоты, а также действующая структура углеводородной цепи.
Способы получения
Простые и сложные эфиры относятся к категории универсальных химических соединений, так как они активно используются в разных отраслях. R-COOR’ получают следующими способами:
- Взаимодействие солей карбоновых кислот с галогенуглеводородами. Эту химическую реакцию можно записать следующим образом: CH3 (CH2)10COONa + CH3Cl → CH3 (CH2)10COOCH3 + NaCl.
- Специфическая этерификация CH2O3 со спиртами. Формула: CH3COOH + C2H5OH → CH3COOC2H5 + H2O.
- Химическая реакция присоединения карбоновых кислот к алкенам: CH3COOH + CH2=CH2 → CH3COOCH2CH3 + H2O.
- Взаимодействие ангидридов CH2O3 со спиртами. Эта химическая реакция может быть записана так: (CH3CO)2O + 2C2H5OH → 2CH3COOC2H5 + H2O.
Свойства R-COOR’ обусловлены тем, что эти соединения относятся к функциональной группе СООН. Под воздействием высоких температур эфиры разлагаются на спирт и кислоту. По причине воздействия раствора щёлочи образуются NaCl и C2H5OH. В качестве примера можно рассмотреть формулу: CH3 — C (O)O — C2H5 + NaOH → CH3COONa + C2H5OH.
приложений
Органический растворитель
Это органический растворитель, который используется для растворения брома, йода и других галогенов; большинство липидов (жиров), смол, чистых каучуков, некоторых алкалоидов, камеди, духов, ацетата целлюлозы, нитрата целлюлозы, углеводородов и красителей.
Кроме того, он используется для экстракции активных компонентов тканей и растений животных, потому что он имеет меньшую плотность, чем вода, и плавает на ней, оставляя нужные вещества растворенными в эфире..
Общая анестезия
Он использовался в качестве общего анестетика с 1840 года, заменив хлороформ для получения терапевтического преимущества. Тем не менее, это легковоспламеняющееся вещество, и, следовательно, сталкивается с серьезными трудностями для его использования в клинических условиях.
Кроме того, он вызывает у пациентов некоторые нежелательные послеоперационные побочные эффекты, такие как тошнота и рвота..
По этим причинам от использования эфира в качестве общего анестетика отказались, заменив его другими анестетиками, такими как галотан..
Дух эфира
Эфир, смешанный с этанолом, использовали для образования раствора, называемого спиртом эфира, который используется для лечения метеоризма желудка и легких форм гастралгии..
Оценка кровообращения
Эфир был использован для оценки кровообращения между рукой и легкими. Эфир вводится в руку, доставляя кровь в правое предсердие, затем в правый желудочек и оттуда в легкие..
Время, прошедшее от впрыска эфира до поглощения запаха эфира в выдыхаемом воздухе, составляет приблизительно 4-6 с..
Учебные лаборатории
Эфир используется в учебных лабораториях во многих экспериментах; например, в демонстрации законов генетики Менделя.
Эфир используется для того, чтобы ошеломить мух рода Drosophila и позволить необходимые пересечения между ними, чтобы выявить законы генетики.
Грибное царство
Пейзаж суши в раннем Девоне – около 400 млн лет назад – мало напоминал сегодняшнюю Землю. Растения, еще лишенные сосудистой системы, покрывали влажные низины густым «лесом», редко достигавшим больше полуметра высоты. Над ними на высоту нескольких метров возвышались гладкие грибные колонны прототакситов.
Они еще не были столь «децентрализованы», как мицелий современных грибов, и под поверхностью земли от «стволов» во все стороны отходили ветвящиеся гифы, которые переваривали мертвую органику и всасывали питательные вещества. Подобно сегодняшним деревьям, прототакситы в палеозой питали целые экосистемы. Они служили пищей и домом первым беспозвоночным суши, на что указывают многочисленные отверстия, словно бы прогрызенные мелкими животными-«вредителями».
Их доминирование продлилось около 70 млн лет, и в ископаемой летописи более поздних периодов столь гигантских грибов уже не встречается. Причина этому не до конца понятна: возможно, они росли слишком медленно, а животным слишком полюбилась «грибная диета» – и прототакситы попросту не успевали восстанавливаться. Но скорее всего, они были вытеснены растениями, конкурируя с ними если не за пищу, то за воду и место. Так или иначе, грибы сами подготовили такой исход.

Ландшафт Девонского периода – около 400 млн лет назад Mary Parrish, National Museum of Natural History






